Ames Test - 原理
Ames 测试菌株是鼠伤寒沙门氏菌和大肠杆菌菌株,它们已被用于检测诱变化合物 40 多年。组氨酸 (鼠伤寒沙门氏菌) 或色氨酸 (大肠杆菌)纵子发生点突变,使细菌无法产生相应的氨基酸。这些突变导致 His 或 trp 生物体除非提供组氨酸或色氨酸,否则无法生长。
通过将这些需要氨基酸的生物体暴露于不同浓度的样品并选择逆转事件来评估测试样品的诱变潜力。缺乏组氨酸或色氨酸的培养基用于此选择,仅允许那些已恢复到组氨酸/色氨酸原营养的细胞存活和生长。导致基因内碱基替换或移码突变的诱变事件可能导致氨基酸原营养逆转。然后,这些恢复的细菌将分别在组氨酸或色氨酸缺乏的培养基中生长,而未恢复的细菌将无法生长。生长期培养基可以是液体或琼脂基培养基。

琼脂板 OECD 471 的 Ames 测试 – 测定说明
将新鲜解冻的冷冻菌株接种在生长培养基中,并在存在(TA98、TA100、大肠杆菌 WP2 [pKM101]、大肠杆菌 WP2 uvrA[pKM101])或不存在(TA1535、TA1537、大肠杆菌 WP2 uvrA)或存在(TA1535、TA1537、大肠杆菌 WP2 uvrA)的情况下,将培养物在 37°C 的环境振荡器中生长过夜氨苄青霉素。隔夜培养物在第er天早上用于 Ames 板掺入或预孵育测定。
将测试菌株在 37°C 下暴露于化学品中 20 分钟,然后接种在Zui小葡萄糖琼脂平板上。预孵育混合物的组分是 S9 混合物或磷酸盐缓冲液、测试化学溶液和细菌培养物。在 37°C 下 20 分钟后,向混合物中加入补充有低组氨酸/生物素或色氨酸并保持在 48°C 的熔融顶部琼脂。将内容物混合并倒入zui小的葡萄糖琼脂平板上。在 37°C 下 48 – 72 小时后,用眼睛计数每个板和每个剂量的菌落数,并与阴性对照板中获得的自发恢复菌落数进行比较。针对 Ames 测试的指南是 OECD 471、ICH M7。

MicroAmes24 - 小型化 24 孔琼脂板 Ames 测试
液体微孔板波动 Ames 测试 OECD 471,ICH M7 – 分析描述
过夜生长与之前描述的程序相同(琼脂板上的 Ames 测试 - 测定描述)。
将细菌暴露于 6 种浓度的测试样品以及阳性和阴性对照中,在含有足够组氨酸(鼠伤寒沙门氏菌)或色氨酸(大肠杆菌)的培养基中 90 分钟,以支持大约两次细胞分裂。暴露后,将每种条件(阴性对照,测试样品和阳性对照)中的培养物在缺乏组氨酸或色氨酸的pH指示剂培养基中稀释,并分装到384孔板的48个孔中。
在两天内,已经逆转为氨基酸原生营养的细胞将生长。在液体 Ames II/Ames MPF™ 系统中,细菌代谢会降低培养基的 pH 值,从而改变细菌所在孔的颜色。计算每个剂量中含有恢复菌落的孔数,并与溶剂(阴性)对照进行比较。每个剂量一式三份进行测试,以便对数据进行统计分析。
相对于溶剂对照,暴露于测试样品时恢复菌落的数量呈剂量依赖性和显着增加,表明样品具有致突变性。
样品的诱变潜力是在肝脏匀浆 S9 提供的代谢激活存在下直接评估的。
针对 Ames 测试的指南:OECD 471、ICH M7。

即用型试剂盒还是单个产品?
即用型检测试剂盒包括菌株、培养基、氨苄青霉素、S9、阳性对照,以液体微孔板形式 Ames MPF™ 以及 6 孔或 24 孔琼脂板形式提供。即用型试剂盒通过菌株的表型、阳性对照以及大鼠肝脏微粒体组分 S9 进行质量控制,因此是一种更加标准化的系统。连续进行稳定性研究、生长控制、S9 和阳性对照的毒性研究。
更多信息:
-
Ames Tester 菌株
-
艾姆斯媒体
-
大鼠肝脏 S9
-
阳性对照
可用的 Ames MPF™ 试剂盒系统,液体微波动分析:
-
艾姆斯 MPF™ Penta 1
-
Ames MPF™ Penta 2 系列
-
艾姆斯MPF™ 98/100
-
艾姆斯二世
-
Ames MPF™ Aqua 用于根据 ISO11350 进行环境采样
可用的 Ames 琼脂板试剂盒系统:
-
MicroAmes24 系列
-
NanoAmes™(开发中)
Ames 测试菌株 – 基因型
大肠杆菌Ames 测试菌株以及鼠伤寒沙门氏菌 Ames 测试菌株已用于检测化学品、药品、化妆品、杀菌剂、水和其他环境样品中的诱变化合物 40 多年。它们都列在指南OECD 471:细菌反向突变测试和指南ICH M7中关于遗传毒性杂质。组氨酸 (鼠伤寒沙门氏菌) 或色氨酸 (大肠杆菌)纵子发生点突变,使细菌无法产生相应的氨基酸。这些突变导致 His 或 trp 生物体除非提供组氨酸或色氨酸,否则无法生长。
通过将这些需要氨基酸的生物体暴露于不同浓度的样品并选择逆转事件来评估测试样品的诱变潜力。缺乏组氨酸或色氨酸的培养基用于此选择,仅允许那些已恢复到组氨酸/色氨酸原营养的细胞存活和生长。导致基因内碱基替换或移码突变的诱变事件可能导致氨基酸原营养逆转。然后,这些恢复的细菌将分别在组氨酸或色氨酸缺乏的培养基中生长,而未恢复的细菌将无法生长。生长期培养基可以是液体或基于
琼脂的大肠杆菌 WP2 pKM[101] 菌株用于基于琼脂的 Ames 测试、基于小型琼脂的 (MicroAmes24) 和液体形式的 Ames 测试 (Ames MPF)。™菌株按照指南 OECD471 ICH M7 使用。

Ames 测试中的代谢 – 大鼠肝脏微粒体分数 S9
大多数分子只有在代谢后才会产生遗传毒性活性。由于细菌无法代谢分子,因此在存在代谢激活系统的情况下直接评估样品的诱变潜力: S9大鼠肝脏微粒体部分 大鼠肝脏匀浆的 S9 部分是在第Y个离心步骤后以约 9000×g 获得的,并且在体外测试系统中模拟肝脏代谢。肝脏 S9 组分包含微粒体和胞质组分。它们包括 I 期和 II 期酶和辅因子。
历史上,肝酶的表达是用 Aroclor 1254 或zui近的苯巴Bi妥/β-萘黄酮诱导的。
值得一提的是,Aroclor 1254 与关于持久性有机污染物的 Stokholm 公约相冲突,已被禁止使用。因此,将来无法保证 Aroclor 1254 诱导的 S9 的可用性。
根据 OECD TG471、ICH M7 或体外哺乳动物细胞微核试验 OECD TG487,在对化学品进行所有遗传毒性研究和环境安Quan评估时,必须考虑测试化合物的代谢
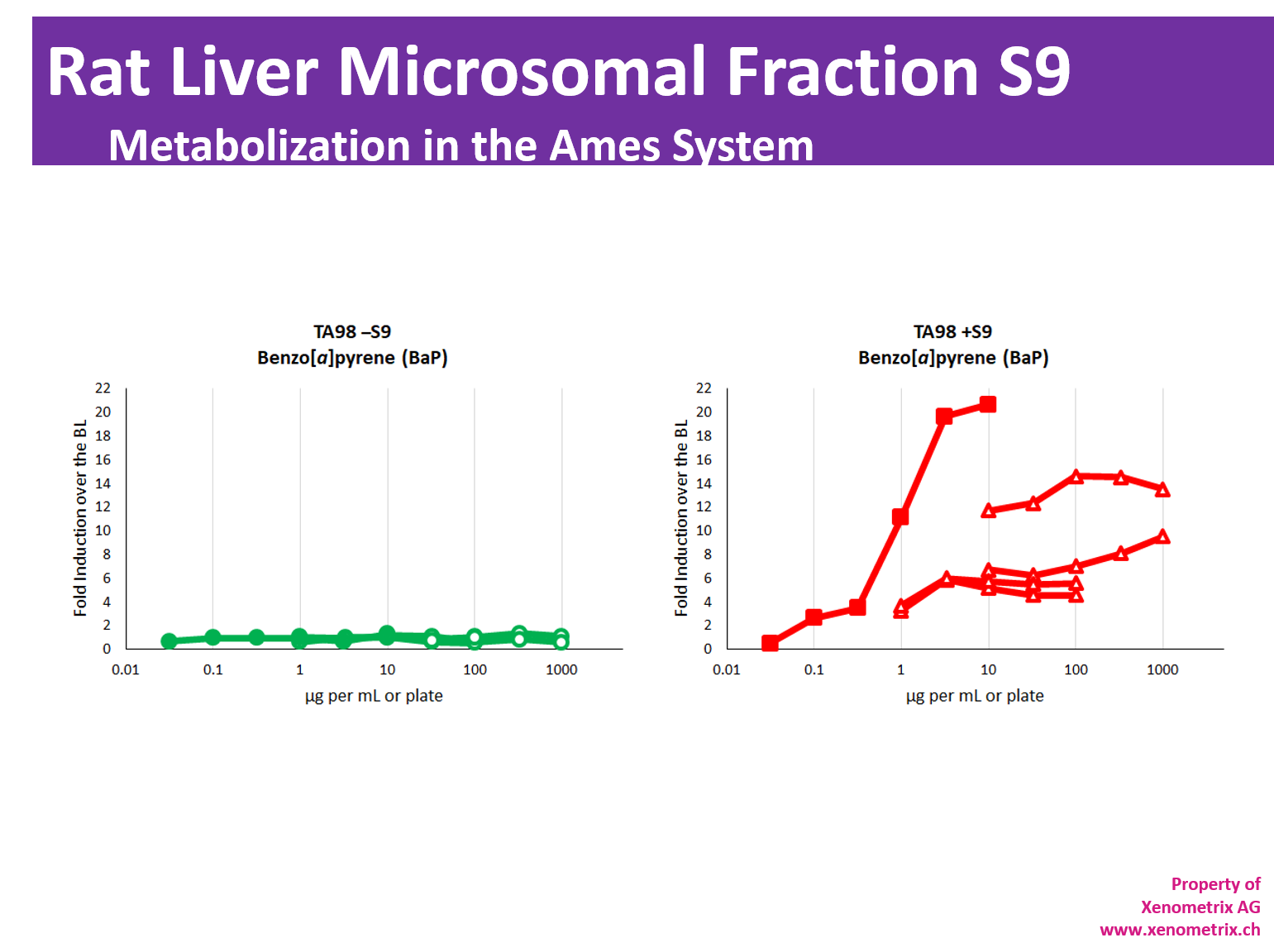
Ames II/Ames MPF™ 中 Aroclor 1254 和苯巴Bi妥/萘黄酮诱导的 S9 的比较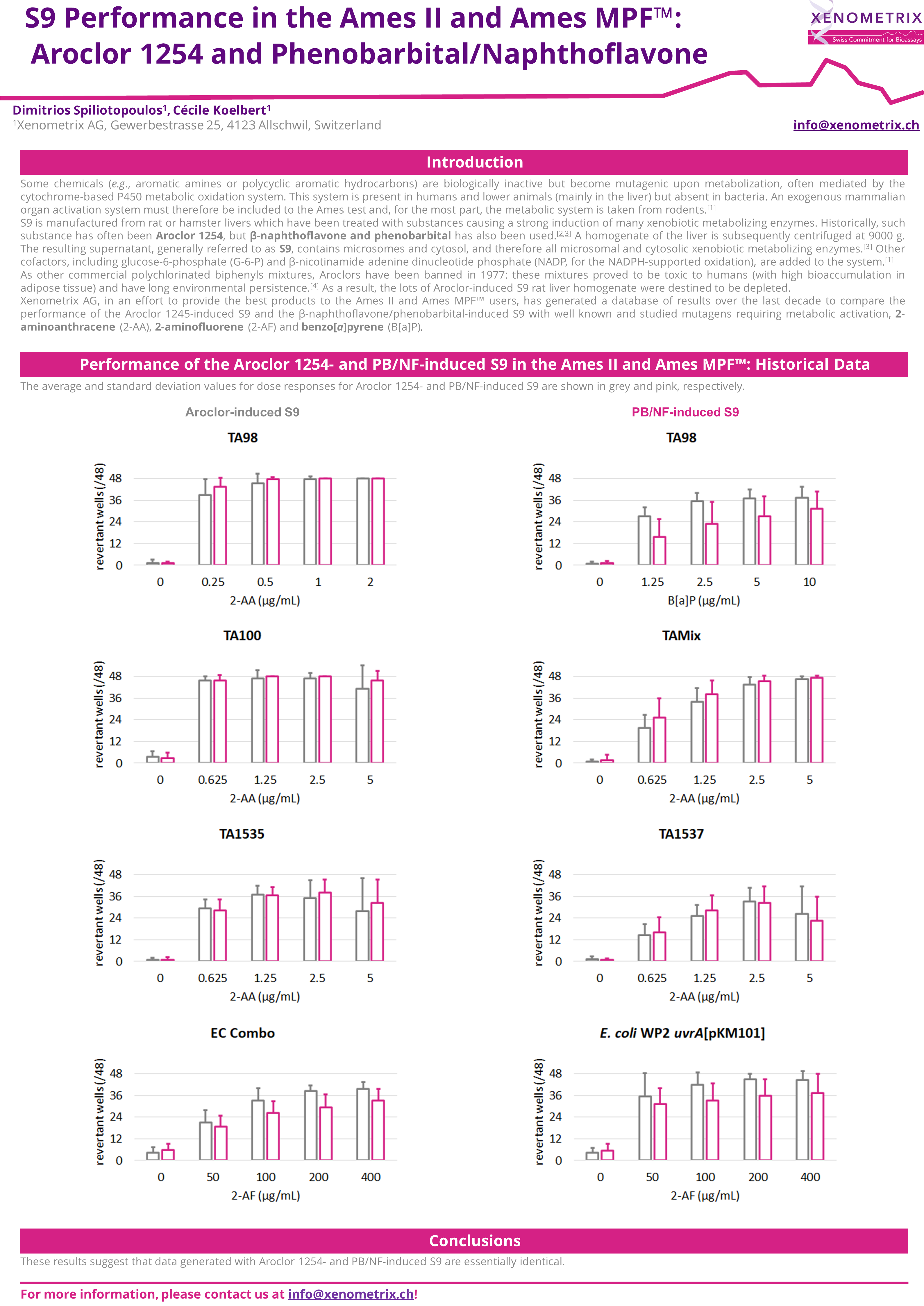
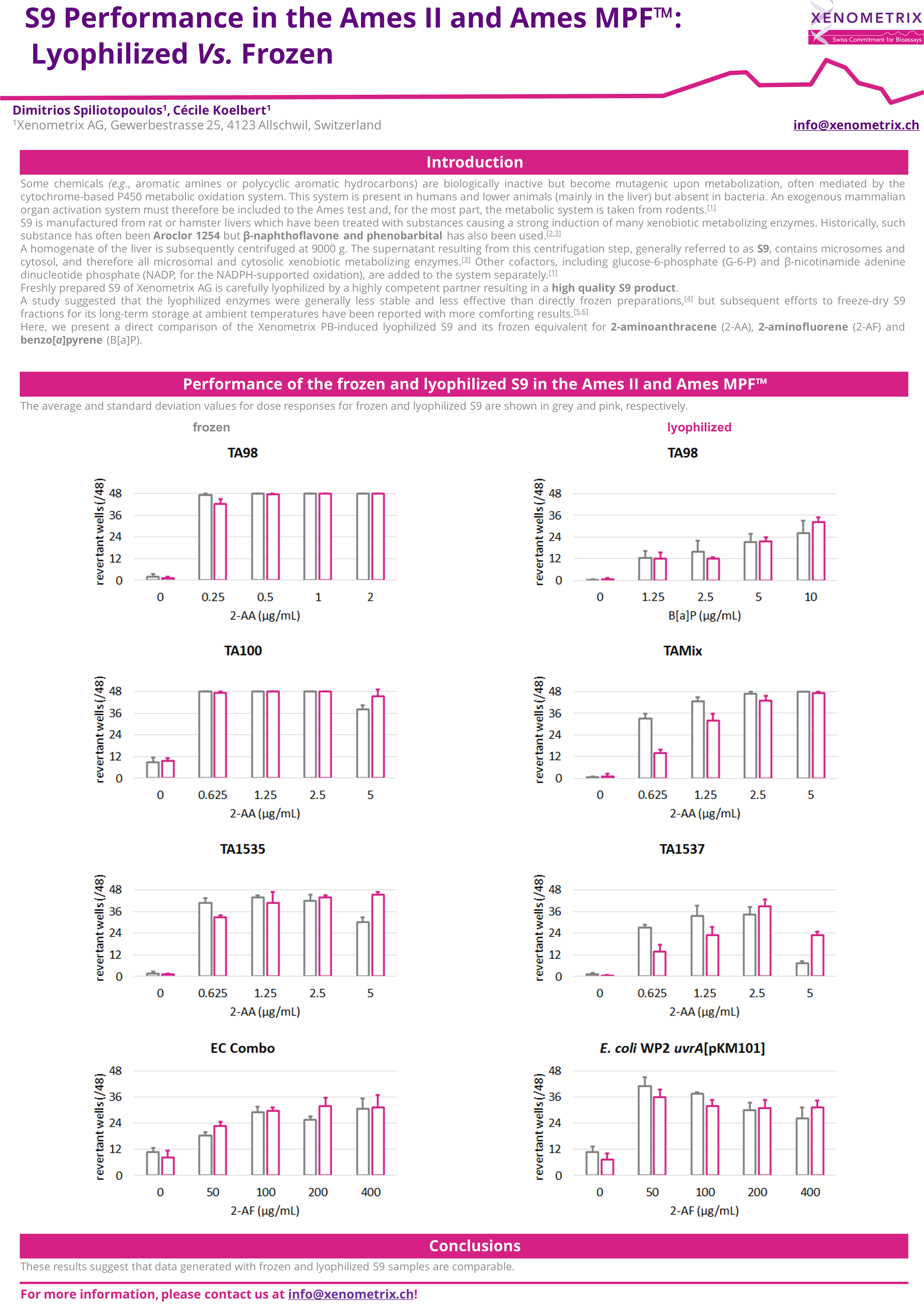
Ames II/Ames MPF™ 中冷冻和冻干 S9 的比较
Ames MPF™ 测试的自动化
-
移液机器人将液体从 96 孔样品板转移到 24 孔板和 384 孔板
-
Ames MPF™ 测试套件是zui方便的自动化模型
-
优点:减少手动作时间、测试化合物数量、S9、塑料垃圾
-
Metafer (metasystems-international.com) 可自动读取和存档 Ames MPF/™ Ames II、微核或染色体畸变测试结果
-
Metafer 扫描各种尺寸的标本,使用许多不同的对比方法和放大倍率
-
Metafer 的模块化设计允许多种应用,如细胞遗传学、毒理学、病理学、血液学。

umuC Easy Test - SOS 反应检测
Xenometrix 提供 umuC Easy 试剂盒,该试剂盒基于国际标准化组织协议 ISO 13829(水质 - 使用 umu 检测法测定水和废水的遗传毒性)。
umuC 测试原理
umuC Easy 检测试剂盒基于基因工程鼠伤寒沙门氏菌 TA1535 [pSK1002],可测量细胞对遗传损伤的 SOS 反应。该试剂盒可在短短 16 小时内通过简单的比色检测对样品的遗传毒性进行清晰、定量的测量。
检测方法描述
: 鼠伤寒沙门氏菌 TA1535 [pSK1002] 细菌暴露于具有潜在遗传毒性的测试化合物。如果受试化合物产生遗传毒性损伤,则 umuC 基因作为细菌 SOS 反应的一部分被诱导。通过lacZ编码的β-半乳糖苷酶将无色ONPG底物(o-硝基苯基-β-D-吡喃半乳糖苷)转化为黄色产物o-硝基苯酚来测量质粒pSK1002上lacZ的诱导。
由于不同种类的遗传毒性损伤会导致 SOS 反应的诱导,因此具有适当报告基因构建体的一株鼠伤寒沙门氏菌足以鉴定所有类别的细菌遗传毒素。与其他细菌遗传毒性和致突变性测定一样,需要代谢激活活性的化合物可以通过添加 S9 微粒体大鼠肝脏提取物来鉴定。
该协议改编自 ISO 13829“水质 - 使用 umu 测试测定水和废水的遗传毒性”。除 S9 辅因子浓度外,所有培养基和试剂均符合 ISO 13829 标准,可与原始 ISO 13829 方案或优化的 umuC-Easy CS 方案一起使用。

Ames Test – 参考文献
-
Ames BN, Lee FD, Durston WE. 1973. An Improved Bacterial Test System for the Detection and Classification of Mutagens and Carcinogens. PNAS USA. 70(3):782–6.
-
Ames BN, Durston WE, Yamasaki E, Lee FD. 1973. Carcinogens are Mutagens: A Simple Test System Combining Liver Homogenates for Activation and Bacteria for Detection. PNAS USA. 70(8):2281–5.
-
McCann J, Choi E, Yamasaki E, Ames BN. 1975. Detection of carcinogens as mutagens in the Salmonella/microsome test: assay of 300 chemicals. PNAS USA. 72(12):5135–9.
-
Ames BN, McCann J, Yamasaki E. 1975. Methods for detecting carcinogens and mutagens with the Salmonella/mammalian-microsome mutagenicity test. Mutat Res. 31(6):347–63.
-
Mortelmans K, Zeiger E. 2000. The Ames Salmonella/microsome mutagenicity assay. Mutat Res. 455(1–2):29–60.
该页面的中文产品信息为翻译内容,仅供参考。准确的产品信息请以厂家的英文说明书为准。本公司产品仅用于科研
